Nature Medicine:外侧下丘脑如何成为脊髓损伤康复的关键突破口?
来源:生物探索 2024-12-08 09:28
LH内的特定神经元——谷氨酸能神经元(LHVglut2)在恢复不完全性脊髓损伤后的步态功能中扮演了至关重要的角色。
脊髓损伤(Spinal Cord Injury, SCI)是全球范围内致残率较高的神经系统疾病之一,其主要表现为由于神经信号传递的中断导致的运动和感觉功能丧失。在部分不完全性脊髓损伤患者中,尽管脊髓与大脑之间的某些神经通路得以保留,但功能恢复往往极其有限且缓慢。如何有效促进这些患者的运动功能恢复,长期以来一直是神经科学和康复医学领域的难题。
近年来,研究人员通过先进技术对大脑和脊髓的神经网络进行了深入探讨,试图找到可以促进脊髓损伤恢复的关键脑区及其潜在机制。在12月2日Nature Medicine最新的研究报道Hypothalamic deep brain stimulation augments walking after spinal cord injury,研究人员首次将目光聚焦于大脑中的外侧下丘脑(Lateral Hypothalamus, LH),一个以调控情绪、食欲和觉醒而著称的脑区。他们发现,LH内的特定神经元——谷氨酸能神经元(LHVglut2)在恢复不完全性脊髓损伤后的步态功能中扮演了至关重要的角色。
更令人振奋的是,研究团队进一步开发了一种基于深部脑刺激(Deep Brain Stimulation, DBS)的创新疗法,通过直接刺激LH,可以即刻改善受损实验动物的步态功能,并在长期康复训练中增强神经网络的重塑能力。而且,这种技术在初步的临床试验中也取得了积极效果,为脊髓损伤患者带来了新的希望。

脊髓损伤(Spinal Cord Injury, SCI)是一种严重影响运动和生活质量的神经系统疾病,其核心问题在于神经信号传递的中断。SCI不仅使患者丧失独立行走的能力,还可能伴随神经痛、膀胱功能障碍和心理问题等长期并发症。虽然部分不完全性SCI患者保留了一定的神经连接,但神经网络的重塑和功能恢复往往极其有限。长期以来,如何促进这一过程一直是神经科学的难题。
近年来,随着神经成像、光遗传学(Optogenetics)和深部脑刺激(Deep Brain Stimulation, DBS)等技术的发展,研究人员得以对脑-脊髓交互进行前所未有的深入探索。该研究将目光聚焦于大脑中的外侧下丘脑(Lateral Hypothalamus, LH),这一传统上以调控情绪、食欲和觉醒而著称的脑区,被发现具有帮助SCI患者恢复步态的潜力。这一发现为SCI的治疗开辟了全新方向,也为那些失去行走能力的患者点燃了新的希望。
从基础到临床的创新路径
全脑时空图谱的构建
该研究的起点是构建一个覆盖全脑的“时空图谱”,旨在揭示不完全性SCI后各脑区在恢复过程中的转录活性和神经连接变化。研究团队利用iDISCO+技术对受损和未受损小鼠大脑进行免疫标记,结合光片显微成像(Light-Sheet Microscopy)实现对整个脑内神经元活性的高分辨率追踪。这一方法允许研究人员对超过1000个脑区进行定量分析,并确定了外侧下丘脑作为关键区域。
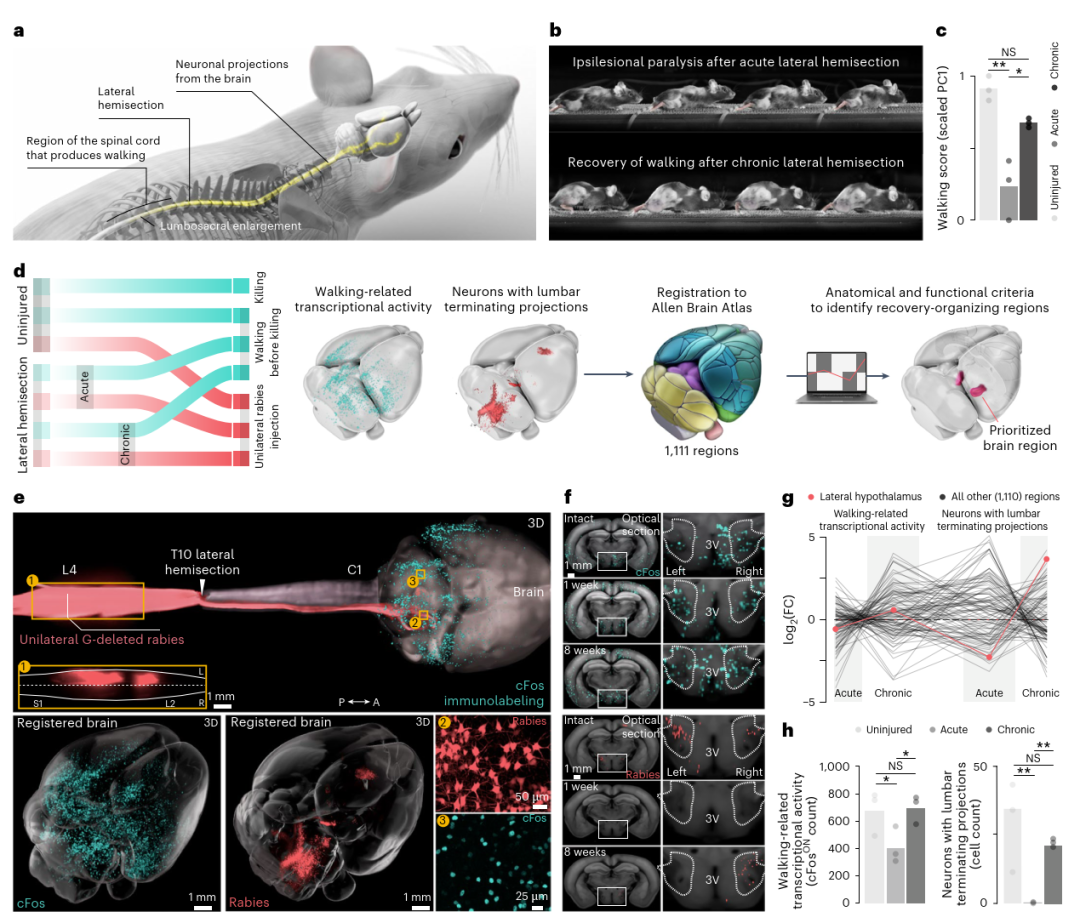
脊髓损伤恢复中外侧下丘脑的核心作用(Credit: Nature Medicine)
实验设计概述
(a) 该研究采用小鼠侧脊髓半切模型(lateral hemisection SCI),该模型能够模拟脊髓不完全性损伤的恢复过程。研究设计的目的是通过建立全脑的时空图谱,探索脊髓损伤后恢复步态功能的关键脑区。
急性与慢性阶段步态变化
(b) 通过对小鼠在SCI后1周(急性期)和8周(慢性期)的步态进行时序摄影(chronophotography),研究团队捕捉了脊髓损伤恢复的动态变化。急性期内小鼠表现出明显的步态缺陷,而慢性期则显示出一定程度的自然恢复。
(c) 研究进一步利用运动学数据对步态进行量化,通过主成分分析(Principal Component Analysis, PCA)提取了步态参数的主要特征。第一主成分(PC1)有效区分了正常小鼠和SCI小鼠的步态。步态得分被定义为小鼠在PC1上的分值(每组小鼠至少记录10次步态循环,n=3)。该定量分析为步态恢复的评估提供了科学依据。
时空全脑图谱的构建
(d) 为了揭示脊髓损伤恢复中全脑神经网络的动态变化,研究采用了cFos免疫标记和G缺失狂犬病毒(G-deleted Rabies Virus)追踪技术。这些方法分别标记了神经活动和与脊髓腰段相连接的神经元。结合3D光片显微成像技术,研究团队绘制了全脑范围内的神经元活动与连接变化图谱。
外侧下丘脑的发现
(e) 通过对全脑的cFos免疫标记和逆行标记的神经元进行三维可视化,研究展示了未受损、急性期及慢性期小鼠脑内关键区域的活跃神经元分布图。这些图像表明,外侧下丘脑(LH)是一个重要的活跃区域,尤其是在慢性期的步态恢复过程中。
(f) 进一步的光学切片显示,未受损、急性期和慢性期小鼠的外侧下丘脑中均有cFos阳性神经元及逆行标记的神经元。这些数据直接表明LH与脊髓损伤恢复密切相关。
数据分析与统计结果
(g) 通过对1111个脑区的转录活性(cFos信号)和脊髓连接神经元密度的对数倍数变化(log fold changes, FC)进行统计分析,研究发现外侧下丘脑是唯一同时满足这些统计显著性变化的脑区(标记为红色)。其他脑区尽管部分满足条件,但未能达到LH的综合表现。
(h) 针对外侧下丘脑的对侧(contralesional, 右侧)数据进一步量化,研究确认了LH的cFos转录活性和逆行标记神经元密度在SCI恢复过程中均显著上升(每组n=3)。统计分析显示LH在步态恢复中扮演了关键角色。
iDISCO+技术
iDISCO+ 是一种免疫标记增强的三维组织透明化技术(Immunolabeling-enabled Three-Dimensional Imaging of Solvent-Cleared Organs, iDISCO)的改进版。该技术的核心目标是通过清除生物组织中的光散射成分(如脂质),使整个组织透明化,从而实现深层结构的高分辨率成像。其基本流程包括以下几个步骤:
固定与脱脂:通过化学试剂(如PFA)固定组织结构,并用有机溶剂(如二氯甲烷)清除脂质以达到透明化效果。
免疫标记:使用特异性抗体标记目标蛋白(如cFos或其他神经活动相关分子),确保荧光信号能够穿透整个组织。
光学透明化:采用改进的有机溶剂(如DBE)使组织达到完全透明的状态,同时保留荧光标记的完整性。
三维成像:通过光片显微镜(Light-Sheet Microscopy)捕捉组织的三维荧光信号,并利用计算机算法重建空间结构。
与传统的组织切片相比,iDISCO+ 技术在以下方面具有显著优势:
全脑可视化:可在单次实验中获得整个脑组织的三维图像,避免切片过程中可能的形变和信息丢失。
深层信号检测:通过透明化处理,使深层组织的荧光信号得以无损传递,适用于大体积组织的标记。
高效标记:增强的免疫标记步骤允许检测低丰度分子,如与神经活动相关的cFos蛋白。
空间分辨率高:结合光片显微镜,能够精确定位特定脑区的神经元活性和网络连接。
在该研究中,研究人员利用 iDISCO+ 技术详细绘制了小鼠脊髓损伤恢复过程中全脑的神经活动分布情况,其主要贡献包括以下几点:
标记神经活动:通过检测神经活动相关的cFos蛋白,研究人员量化了不同时间点、不同脑区内活跃神经元的分布和密度。这为揭示外侧下丘脑在步态恢复中的关键作用提供了直接证据。
追踪神经连接:通过联合使用缺失糖蛋白的狂犬病毒(G-deleted Rabies Virus),研究人员标记了与脊髓腰段相连的神经元。这种双标记策略显示,LH中的谷氨酸能神经元在脊髓损伤恢复中与脑干和脊髓的神经投射密切相关。
动态变化分析:研究团队在SCI后1周(急性期)和8周(慢性期)分别进行了脑组织分析,发现外侧下丘脑在急性期内的转录活性下降,而在慢性期逐步恢复并超过基线水平。这样的动态变化模式表明LH在神经恢复中发挥了重要调控作用。
动物实验:揭示外侧下丘脑的作用
在确认外侧下丘脑可能在SCI恢复中发挥作用后,研究人员采用光遗传学技术进一步验证其功能。他们将带有通道视蛋白(Channelrhodopsin, ChR2)或抑制性蛋白的腺相关病毒(Adeno-Associated Virus, AAV)注入LH,以选择性地激活或抑制谷氨酸能神经元(LHVglut2)和抑制性神经元(LHVgat)。实验结果显示,激活LHVglut2能够显著改善小鼠的步态协调性和运动能力,而抑制这些神经元则会导致步态恶化。
随后,为了评估这种作用的即时性和长期性,研究团队开发了基于深部脑刺激的创新疗法(DBS-LH)。通过将电极植入LH区域并进行精确电刺激,他们观察到小鼠和大鼠在SCI后的运动能力得到显著提升。这种疗法不仅能够即时改善动物的步态,还在长期训练中促进了神经网络的重塑。
人体临床试验:从理论到实践的跨越
在动物实验取得成功后,研究团队对两名不完全性SCI患者进行了初步临床试验。患者在术前接受功能性磁共振成像(fMRI)和弥散张量成像(DTI)检查,以精确定位LH中负责运动功能的区域。通过将DBS电极植入目标区域,并结合步态评估,他们验证了这种疗法在人类中的有效性。
实验动物中的即时改善与长期效应
在小鼠和大鼠模型中,研究人员发现,DBS-LH能够立即改善运动能力。SCI后严重受损的动物在接受刺激后恢复了行走能力,其步态参数(如步长和步频)接近正常水平。进一步分析表明,这一疗效主要得益于神经通路的重塑:LH通过脑干的腹侧巨细胞核(vGi)与脊髓形成连接,而这一连接在SCI后得到显著加强。
人类临床试验的突破性成果
在人类临床试验中,DBS-LH也展现了令人瞩目的效果。两名参与者在接受刺激后,下肢肌肉的活动显著增强,步态的协调性和耐力均有改善。一名患者表示,“我能感到腿部有运动的冲动”,而另一名患者成功实现了在家庭环境中独立上下楼梯的目标。更令人振奋的是,在三个月的康复训练后,即使关闭刺激装置,患者的运动功能仍显著优于治疗前。这表明,DBS-LH可能通过神经通路的重塑实现了长期疗效。
科学机制:跨越损伤的神经网络重塑
研究表明,LH中的LHVglut2神经元是促进运动恢复的核心。这些神经元并不直接作用于脊髓,而是通过与脑干vGi神经元的连接,将信号传递至脊髓的腰段区域。vGi神经元的稀疏分布确保了一部分投射能够在SCI后幸存,从而成为信号传递的关键桥梁。此外,DBS-LH还促进了脊髓局部神经元的轴突再生,使神经网络得到进一步强化。
突破性发现的意义
该研究最大的亮点在于,研究团队通过全脑时空图谱发现了外侧下丘脑在SCI恢复中的核心作用,并通过光遗传学技术和DBS实验验证了这一作用的机制。他们发现,LH中的谷氨酸能神经元(LHVglut2)通过连接脑干的腹侧巨细胞核(Ventral Gigantocellular Nucleus, vGi),将信号传递到脊髓的腰段区域,形成了“跨损伤”的神经连接。这种连接不仅在SCI后自然恢复中发挥了重要作用,更在DBS-LH的干预下被显著增强。研究同时证明,DBS-LH可以即刻改善步态,并通过神经网络重塑实现长期疗效。这些发现为SCI治疗打开了新的窗口,同时也提出了一些引人深思的问题。
临床转化的机遇与挑战
尽管DBS-LH在动物模型和初步临床试验中表现出了令人振奋的效果,但其广泛应用仍面临多重挑战。
首先,SCI患者的损伤类型和程度具有高度异质性,并非所有患者都保留足够的神经通路来响应LH刺激。因此,如何开发精准的筛查工具,识别最有可能受益的患者群体,将是未来研究的重点方向。这需要结合功能性磁共振成像(fMRI)、弥散张量成像(DTI)和电生理评估等多模态数据,建立个性化的治疗决策框架。
其次,深部脑刺激的实施需要高度精确的电极植入技术和优化的刺激参数。在临床试验中,研究团队通过术中神经活动监测和术后刺激优化,实现了对LH复杂几何结构的精确定位。然而,这种方法的操作复杂性和成本限制了其广泛应用的可能性。未来,开发更加高效、经济的刺激技术和设备,例如非侵入性脑刺激或自动化的参数优化系统,将显著提升其临床可及性。
此外,DBS-LH的长期安全性仍需进一步验证。尽管初步试验未观察到严重的不良事件,但脑刺激可能带来的心理或内分泌副作用,例如情绪波动、体重变化或激素水平异常,仍需在更大规模的临床试验中重点评估。同时,不同患者对刺激的反应可能存在个体差异,因此需要建立长期随访机制,动态调整治疗策略。
科学问题与未来方向
从科学角度看,该研究也引发了一系列关于脑-脊髓交互机制的深层问题。例如,外侧下丘脑的运动调控功能是否仅限于SCI恢复,还是在正常运动中也扮演关键角色?LHVglut2神经元是否存在更多未被发现的下游通路,这些通路又如何在不同的运动模式中协同工作?此外,研究表明,脊髓电刺激(Epidural Electrical Stimulation, EES)同样能够促进SCI后的神经功能恢复。将DBS-LH与EES结合是否会产生协同效应,为患者带来更大的康复可能性?这些问题的答案将有助于进一步完善SCI治疗的理论框架。
综上,该研究为脊髓损伤的治疗提供了一种突破性的思路:通过深部脑刺激激活外侧下丘脑,实现神经通路的重塑和功能恢复。这一发现不仅为SCI患者带来了希望,也为神经科学和康复医学领域提出了新的挑战。未来,随着技术的不断进步和科学问题的逐步解答,DBS-LH有望成为SCI治疗的重要组成部分,帮助更多患者重获行走能力,重新拥抱生活的自由与尊严。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


